Ejemplos de isótopos
Los isótopos son átomos de un mismo elemento que contienen la misma cantidad de protones y electrones, sin embargo, difieren en número de neutrones. Así pues, estos átomos comparten el mismo número atómico, pero difieren en su masa atómica.
La palabra isótopo tiene origen griego, y significa “en el mismo sitio”. Esto quiere decir que todos los tipos de átomos de un elemento químico están ubicados en el mismo sitio dentro de la tabla periódica de elementos químicos. La mayor parte de los elementos químicos poseen más de un isótopo, y sólo 21 elementos tienen sólo un isótopo natural (ejemplos de esto son el berilio y el sodio). Por su parte, el estaño es el elemento con mayor número de isótopos (diez).
Existen diferentes 3 tipos de isótopos:
1) Isótopos estables
2) Isótopos no estables
3) Isótopos radioactivos
Elementos como el uranio también poseen varios isótopos naturales, sin embargo éstos son inestables, por lo que pueden transformarse, proceso en el cual emiten radiación, por lo cual se dice que son radioactivos. En el caso de los isótopos radioactivos, lo que sucede es que el número de neutrones es mucho mayor que la de protones.
Por su origen, los isótopos se clasifican en:
1) isótopos naturales
2) isótopos artificiales.
Los isótopos naturales son los que, como su nombre lo dice, se encuentran en la naturaleza de forma natural, mientras que los isótopos artificiales son los que se producen en laboratorios nucleares por bombardeo de partículas subatómicas.
15 ejemplos de isótopos:
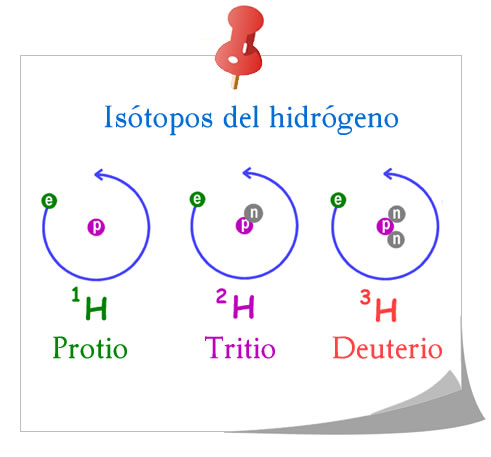
1) El hidrógeno posee tres isótopos naturales: El protio, el deuterio y el tritio.
2) El carbono también posee isótopos naturales: El carbono-12, el carbono-13 y el carbono-14.
3) En el caso del Zinc, sus isótopos son el zinc-64, el zinc-66, el zinc-67, el zinc-68 y el zinc-70.
4) El Galio posee como isótopos al galio-69 y el galio-71.
5) El Rubidio posee dos isótopos: rubidio-85 y rubidio-87.
6) Otros ejemplos de isótopos son el paladio-102, paladio-104, paladio-105, paladio-106, paladio-108, paladio-110.
7) En el caso de la plata, los isótopos son: plata-107 y plata-109.
8) Indio-113 e indio-115 también son ejemplos de isótopos.
9) Como se dijo antes, el estaño es el elemento con más isótopos, éstos son: estaño-112, estaño-114, estaño-115, estaño-116, estaño-117, estaño-118, estaño-119, estaño-120, estaño-121, estaño-122, estaño-124.
10) Platino-192, platino-194, platino-195, platino-196, platino-198.
11) Mercurio-196, mercurio-197, mercurio-198, mercurio-199, mercurio-200, mercurio-201, mercurio-202, mercurio-203, mercurio-204.
12) Cadmio 106, cadmio-108, cadmio-110, cadmio-111, cadmio-112, cadmio-113, cadmio-114, cadmio-115, cadmio-116.
13) Cerio-140, cerio-142.
14) Rutenio-96, rutenio-98, retenio-99.
15) Disprosio-167, disprosio-168, disprosio-170.